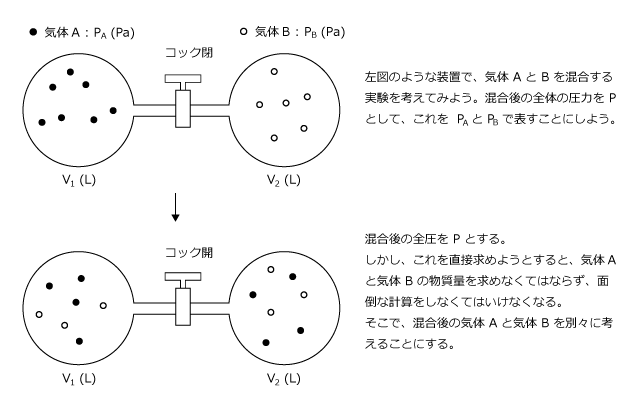
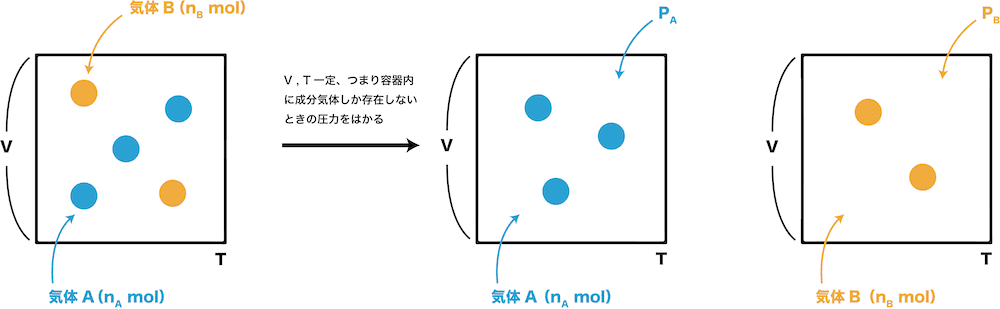
混合比(こんごうひ、英語 mixing ratio、humidity ratio )とは、大気中に含まれる水蒸気量の表現の1つで、湿潤空気を含む空気塊における、乾燥空気に対する水蒸気の質量の比のこと。 単位体積とすれば密度の比に等しい。 以下の2つの基本問題のとらえ方の違いについてです。計算過程は省略しておきます。問A・・・空気を酸素と窒素の体積比が 1対4 の混合気体であるとして、 1atmの空気中の酸素と窒素の分圧を求めよ。問B・・・3Lの容器に4atmの酸計算式(6)から求められた飽和水蒸気圧 P tot = 全圧 K = 乾湿計係数 ℃1 水蒸気圧Pwが分かっている場合、相対湿度RHは計算式(1)から計算できる、または 露点Tdは計算式(7)を用いて計算できる。 例 湿球温度Twetが385℃、乾球温度Tdryが400℃、全圧Ptotが1013hPaのと
化学講座 第37回 分圧の法則と2気体の混合 私立 国公立大学医学部に入ろう ドットコム
分圧 体積比
分圧 体積比-分圧ぶんあつ 混合気体において,その混合気体で占めている全容積をそれぞれの成分気体だけで占めるときに示す圧力。 たとえば 空気 は 窒素 と酸素の体積の比が4対1であるから,1気圧の窒素の分圧は5分の4気圧,酸素の分圧は5分の1気圧となる大気の組成は体積比で表されることが多い。地球の大気のように理想気体 (後述)とみなせる気体においては、体積比は、物質量の比や分圧の比に等 しい。体積比ではなく質量比で示した場合には、組成の値が異なることに注 意が必要である。




化学講座 第37回 分圧の法則と2気体の混合 私立 国公立大学医学部に入ろう ドットコム
混合気体の分圧比・モル比・体積比について 以下の2つの基本問題のとらえ方の違いについてです。 計算過程は省略しておきます。 問A・・・空気を酸素と窒素の体積比が 1対4 の混合気体であるとして、 1atmの空気中の酸素と窒素の分圧を求めよ。数学・算数 分圧の算出方法 1Lの容器にN2、O2、Arが体積比で235封入。圧力計が5気圧(絶対値)を示している。 各気体の分圧を求めよ。 また、℃の場合の分圧を求めよ。 状態方程式を 質364 - 2.飽和蒸気表 a 水の飽和表(圧力基準) 圧 力 MPa 温度 ℃ 比体積(m 3/裴) 密度(裴/m 3) 比エンタルピ(kJ/裴) 比エントロピ kJ(裴・K) 000 0005
分圧は、各成分気体が単独に全体積を占めたときの圧力ですから、 A の分圧:1気圧×1/1=1気圧 B の分圧:1気圧×2/1=2気圧 となり、分圧の比=体積の比 となっていることがわ気体の体積 求め方 物質量〔mol〕= モル体積224 L/mol 標準状態での気体の体積〔L〕 二酸化炭素も酸素も水素も、標準状態において1 molの体積は224 Lとなります アボガドロの法則とは物質の種類に関係なく、 物質量(モル)と分子数や気体の体積が比例するという法則です。は,圧力倍(圧力比)ということ。 1 溶媒の体積 は,溶媒(ほぼ水)の体積倍(体積比)ということ。 解法の手順 ℃,10×105Paにおいて,酸素は水1Lに,mol溶ける。 物質量で与えられている例 体積で与え
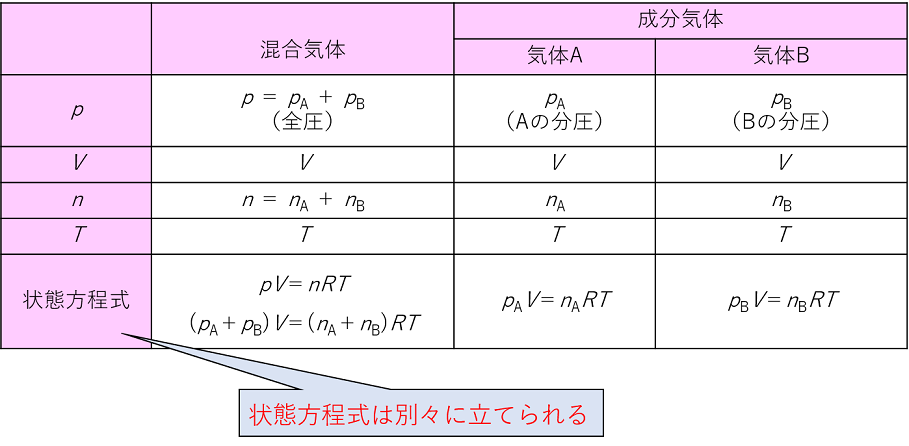
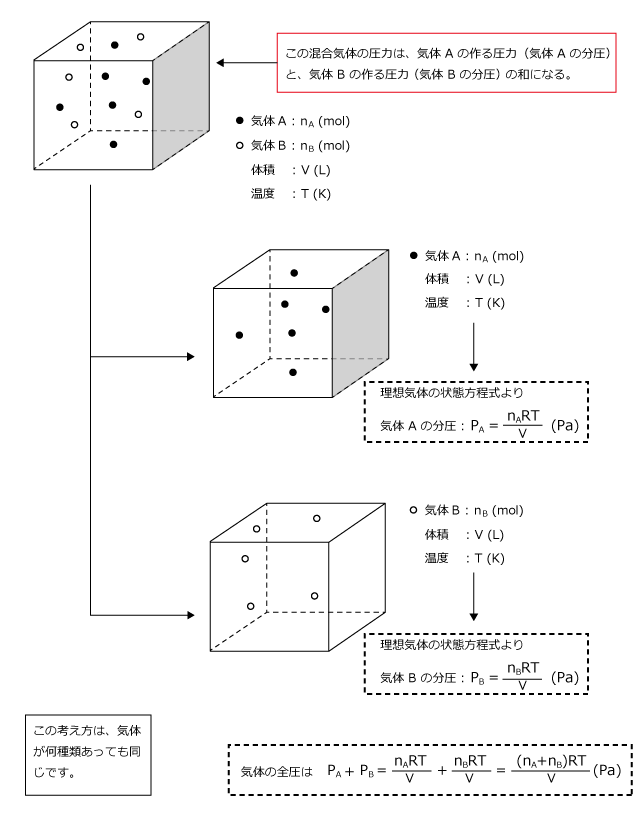
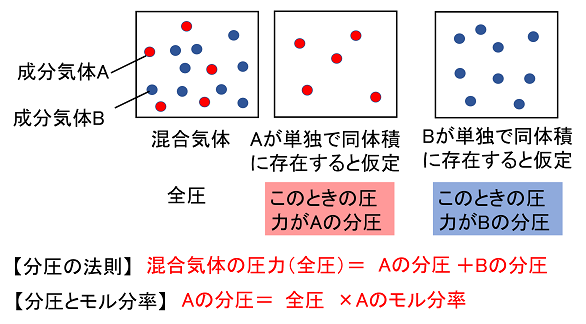
多成分からなる混合気体において、ある1つの成分が混合気体と同じ体積を単独で占めたときの圧力を、その成分の分圧 (英語 partial pressure )という 。 たとえば酸素の分圧は酸素分圧と呼ばれる。 ドルトンの分圧の法則によれば、混合気体の圧力(全圧)は各成分の分圧の和に等しい。 解答:V 全 :L V H 2 :33L V N 2 :50L まずは、気体の状態方程式を使って全体積を求める。 P V = n R T V = n R T P = 050 × × 10 3 × ( 27 273) 15 × 10 5 = ( L) 次に、全体積にH 2 とN 2 それぞれのモル分率をかけることで分体積を求める。 全 V H 2 = V 全 体積Lの容器に0molの水素H 2 と030molの窒素N 2 を入れて27℃にした。このときの混合気体の全圧、またH 2 とN 2 の分圧をそれぞれ求めよ。(気体定数R=×10 3 とする)



分圧比 モル比 体積比とかいてあるのですが 左ページの一番下の問 Yahoo 知恵袋




混合気体と圧力 Chemihack おうちで学べる化学
混合気体において分圧比とモル比は等しくなります。混合気体中の 1 成分のモル数を混合気体全体のモル数で割った値をモル分率というので覚えておきましょう。 ではここで理想気体の状態方程式 p v = n r t( p 圧力 v 体積 n 物質量=モル r 気体定数 t 温度 )を思い出しましょう。化学の公式解説ページ (気体編) 2組全体へ 01番 気体の法則 四つの物質量 圧力P・体積V・物質量n・温度T ボイルの法則 T,n一定のとき、PV=(一定) シャルルの法則 :P,n一定のとき、V/T= (一定) 注:温度は、セルシウス温度tではなく絶対温度T(K体積比は 富=1514 窒素 15 mLしメ 酸素 28 mLメ それぞれの分圧における体積で表した気体の溶解量 は) 圧力に関係なく一定と考えられるので, 守素 15 mLxそ0エー30 mL 0L 1 な の 陵素 28mLxででエ 貞っでて, 体積比は 30 56ニ15 28 56 mL




改訂化学基礎 改訂化学 ダイジェスト版




高校化学の気体の問題です 若干複雑ですが 回答していただけると嬉しいです Clear
一定の温度,体積の中では,各成分気体の分圧は,気体の状態方程式から( 物質量 )に 比例する。したがって,分圧の比は混合気体の( 物質量の比 )になる。 例題 27℃で一定容積の容器に窒素N 2 molと酸素O 2 30 molを入れると,混合気体の全圧分圧比=モル分率(=体積比=分子数比) 成分Aの濃度が1ppmの場合、 ・体積106cm3の空気は、1 cm3のAを含む。 ・空気の分子106個あたり、Aの分子が1個存在する。 ・空気106molは、1molのAを含む。 ・1気圧(atm)の大気中で、Aの分圧は106atmである。分圧、分体積をつかいます。 今回は 分体積 です。 体積がモルに比例しているのが V=knの式からわかりますね! 問題文を図に表す。 この問題文を忠実に図にすると、 こうなります。 変化量の問題は、




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾



ドルトンの分圧の法則と混合気体の状態方程式
Mole fraction 熱工学 組成の一つの表現法. r 成分の混合物の i 番目の成分のモル数が Ni であるとき, i 番目の成分のモル分率 ri は ri = N i r ∑ i=1N i r i = N i ∑ i = 1 r N i である.理想気体の混合物においては,モル分率は体積比および分圧の全圧に対する比に気体i の体積をVi,混合気体の体積をV = åVi とすると,気体i の体積分率Xi は 次のように表される. Xi = Vi V (1) 気体i のモル数をni,混合気体のモル数をn = åni とする.また,圧力をp,気体 定数をR,温度をT とする.理想気体の状態方程式から,気体i のモル体積 質量1 乾き空気 水蒸気 湿り空気 圧力 体積 質量X 圧力 体積 質量1 加わると〔飽和空気〕 水蒸気が飽和状態 にある空気 圧力 体積 質量1 ⑤顕熱比 空気の状態変化で、熱量の変化の内、顕熱量をqs、潜熱量 をqLとすると、 (SHF) (qsqL)




体積比 容積比 とモル比 物質量比 が一致する理由 定積 定温下



化学気体なぜ 混合気体では分圧の比 体積の比になるのでしょうか 具 Yahoo 知恵袋
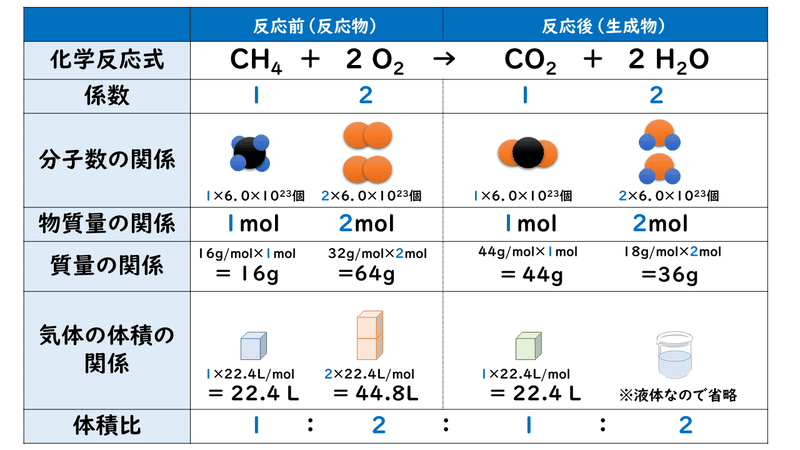
答A・・・酸素の分圧 02×1atm 窒素の分圧 08×1atm 答B・・・酸素の分圧 24×1atm 窒素の分圧 08×1atm 問Aでは分圧比=体積比になりますが、問Bでは分圧比≠体積比です。 (1) 酸素12molと窒素48molを体積166Lの容器に入れ、温度を47℃に保った。混合気体の全圧と各気体の分圧を求めよ。 (2) 空気を酸素と窒素の体積比が1:4の混合気体であるとして、\( 15 \times 10^5 Pa \) の空気中の酸素と窒素の全圧を求めよ。(分圧の比)と(物質量の比)は同じになる。 問2 メタン(CH 4 )96gと一酸化炭素(CO)56gの混合気体の圧力が10気圧の時、メタンの分圧は何気圧か。



分圧 全圧 モル分率 化学のグルメ




49 化学 気体 全圧と分圧 Youtube
比表面積は単位重量の粉体中に含まれる全粒子の表 面積の総和Sw(cm2/g) であらわすのが普通であるが, 単位体積あたりの全表面積Sv(cm2/cm3) で示すこと もある ここで単位体積というのは粉体の見かけ体積 (かさ) ではなく固体分だけの実質体積である した分圧比=体積比になるのはなぜ? 化学の混合気体の分野の質問です。よく参考書で、 「モル比=分圧比=体積比」・・・ ︎ というものを見かけますが、これがどうしてもよくわかりません。(同内容の他の知恵袋などの記事も見て回りましたがやはり理解できませんでした)About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How works Test new features Press Copyright Contact us Creators




化学講座 第37回 分圧の法則と2気体の混合 私立 国公立大学医学部に入ろう ドットコム



混合気体の分圧を解説 仕組みがわかれば簡単 受験メモ
気体の容積比の百万分率です。その数値は、空気など媒体1L中のμl に相当します。 mg/m 3 (milligram per cubic meter) 単位体積中の物質の濃度を表し、その数値は空気1m 3 (1,000L)中のmgに相当します。主として粒子状物質の濃度を表すときに使われますが、稀に比体積 単位質量の物質が占める体積のことです。 比体積は 密度 の逆数にあたり、ある物質の質量を M kg、体積を V m 3 とすると、比体積 v m 3 /kg は以下の式によって求められます。 CAE用語集 50音順索引 あ行 50音順索引 か行 50音順索引 さ行 50音順




分圧と燃焼の問題 27 で2 0l 2 0 10 5paのcoと 27 Okwave



混合気体の分圧を解説 仕組みがわかれば簡単 受験メモ



混合気体について 空気は 体積百分率で窒素80 酸素 Yahoo 知恵袋




気体 混合気体とドルトンの分圧の法則 Youtube




分圧の法則と計算問題 理系ラボ



化学気体なぜ 混合気体では分圧の比 体積の比になるのでしょうか 具 Yahoo 知恵袋




この標準状態における体積比とそれぞれの分圧における体積比はどう違うのでしょうか Clear




混合気体の全圧と分圧 ドルトンの分圧の法則




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾




係数比 Mol比 気体の体積比 分圧の比 化学がちょっとだけ好きな社労士




分圧の法則と計算問題 理系ラボ




高校理論化学 混合気体 ドルトンの分圧の法則 分圧とモル分率 受験の月



混合気体の全圧と分圧 ドルトンの分圧の法則




体積比の意味 用法を知る Astamuse




混合気体 1 全圧と分圧 理系への道




267 Sum N Times 105pa Descubre Como Resolverlo En Qanda




高校化学 分圧とモル分率 映像授業のtry It トライイット




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾




高校化学 ドルトンの分圧の法則 映像授業のtry It トライイット




2枚目の写真の左の式は 分圧の法則 右の式は アボガドロの法則 と言えますか Clear




この標準状態における体積比とそれぞれの分圧における体積比はどう違うのでしょうか Clear




気体の燃焼の計算 閉鎖系 問題と答え 大学受験の王道



くまなび 理論化学演習004




2 の で体積一定のとき 分圧比と物質量比が等しいとありますが3 で 化学 教えて Goo




問題 の操作1でaは温度と圧力が一定だから体積比はモル比になると解説 化学 教えて Goo




1 で 標準状態換算でヘンリーの法則は同じ温度下で成り立つなら での全圧を0 Clear




5分でわかる 分圧 全圧との違いは 混ざっているのに圧力は分けられる 元研究員がわかりやすく解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン



混合気体の分圧を解説 仕組みがわかれば簡単 受験メモ




ヘンリーの法則とは 公式はどう使う 問題を解いて気体の体積との関係を理解しよう 高校生向け受験応援メディア 受験のミカタ



混合気体の圧力



1



1



化学講座 第37回 分圧の法則と2気体の混合 私立 国公立大学医学部に入ろう ドットコム



5 2 化学反応の量的関係 1 おのれー Note



0c 101times105pa 100l Ch Lihat Cara Penyelesaian Di Qanda



理想気体の状態方程式



同温 同圧では物質量の比は体積比とはどういう意味ですか モル分率は成 Yahoo 知恵袋



混合気体の圧力



1



第95章 混合気体
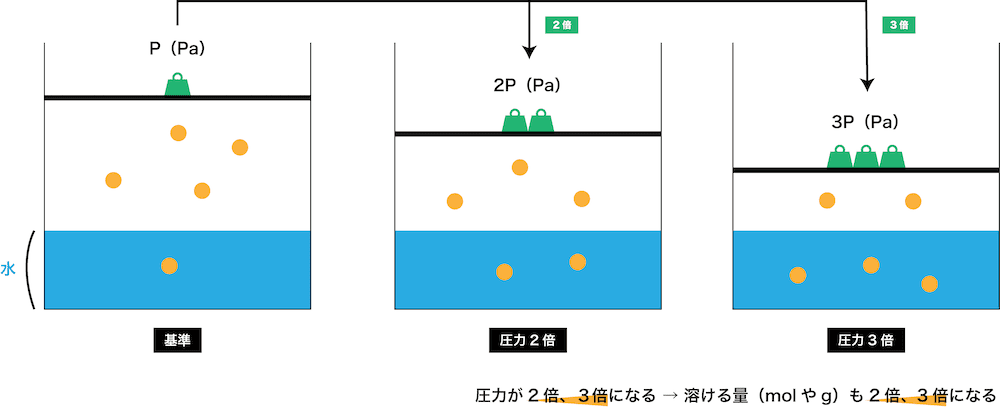



気体の溶解度 ヘンリーの法則 体積や圧力との関係 計算問題 化学のグルメ



ドルトンの分圧の法則と混合気体の状態方程式



ドルトンの分圧の法則と混合気体の状態方程式




気体の性質 混合気体の反応後の量を求める過程がわかりません 化学 定期テスト対策サイト



ドルトンの分圧の法則と混合気体の状態方程式



ドルトンの分圧の法則と混合気体の状態方程式




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾



物質量比 体積比 分圧比なのですか 違うとしたらどのようになるのですか Yahoo 知恵袋
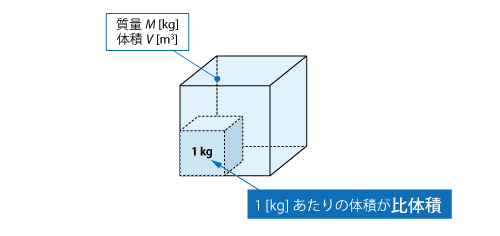



比体積




1 ボイルの法則 シャルルの法則 2 ボイル シャルルの法則 3 気体の状態方程式 実在気体 Ppt Download




高校化学 ドルトンの分圧の法則 映像授業のtry It トライイット
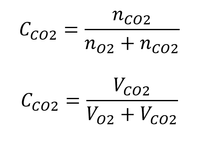



第3章



06 化学 混合気体 2 平均分子量 鈴木 鉄男




1 ボイルの法則 シャルルの法則 2 ボイル シャルルの法則 3 気体の状態方程式 実在気体 Ppt Download



38章 湿り空気




1 3 1 気体の体積の変化




分圧の法則と計算問題 理系ラボ




係数比 Mol比 気体の体積比 分圧の比 化学がちょっとだけ好きな社労士



第95章 混合気体




全圧と分圧とは ドルトンの法則 分圧の法則 とは 計算問題を解いてみよう モル分率や質量分率との関係



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Mixed Gas
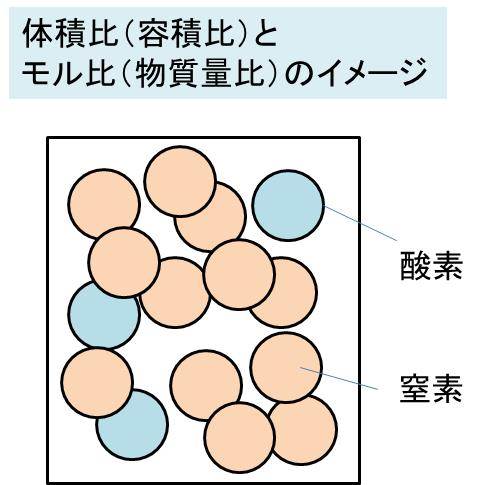



体積比 容積比 とモル比 物質量比 が一致する理由 定積 定温下



混合気体で分圧 分体積の問題です ボイルの法則が成り立つ理由が Yahoo 知恵袋




混合気体と圧力 Chemihack おうちで学べる化学



Nasa Cea




理論 気体 Kumonotaira




分圧の法則と計算問題 理系ラボ




全圧と分圧とは ドルトンの法則 分圧の法則 とは 計算問題を解いてみよう モル分率や質量分率との関係



Http Pdf Manavee Com S3 Website Ap Northeast 1 Amazonaws Com 81 93 81 A3 81 A6 8a Bf E5 8c 96 E5 Ad A6 E9 96 E6 9d B1 E9 A8 80 80 Ef 9e E7 90 86 E8 Ab 96 E7 A8 Ef 9e 06 E6 B0 97 E4 93 81 Ae E4 93 E7 8d 81 A8 E5 9c E5 8a 9b E6 B8 E5 Ba A6 Pdf



気体の分圧と大気成分の濃度




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾



混合気体の全圧と分圧 ドルトンの分圧の法則




この標準状態における体積比とそれぞれの分圧における体積比はどう違うのでしょうか Clear




5分でわかる 分圧 全圧との違いは 混ざっているのに圧力は分けられる 元研究員がわかりやすく解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン



混合気体の分圧を解説 仕組みがわかれば簡単 受験メモ




ヘンリーの法則の計算 問題と答え 大学受験の王道



Introduction To Hydrological Cycle Koji Yamazaki Ir Image




1 3 1 気体の体積の変化



1




高校理論化学 気体の溶解度 ヘンリーの法則4パターン 受験の月



化学 混合気体の状態方程式 技術情報館 Sekigin 実在気体の例として 混合気体を扱う際に基本となる分圧の法則 分体積の法則を紹介



化学 混合気体 空気 について 技術情報館 Sekigin 実在気体の例として 空気を考える際の基本として 空気の組成 混合気体の状態方程式を用いて 窒素と酸素の関係などを紹介



ドルトンの分圧の法則と混合気体の状態方程式



ドルトンの分圧の法則と混合気体の状態方程式




混合気体について 混合気体について 高校化学の混合気体について わから Okwave




ヘンリーの法則まとめ 公式 体積 問題 理系ラボ




混合気体の分圧 分体積の計算法 史上最強の解法がここに 化学受験テクニック塾




気体の状態方程式について ここでのtとvの関係について T 273kのときv 化学 教えて Goo
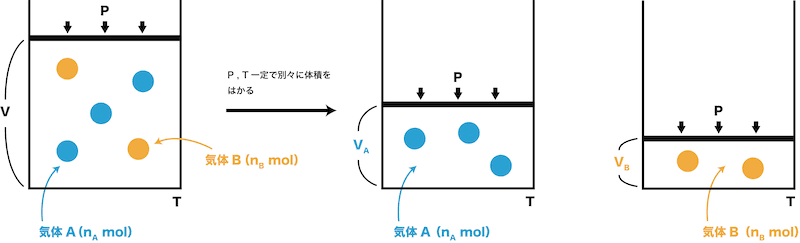



分体積 全体積 化学のグルメ




立命館大学 ヘンリーの法則 計算問題 化学がちょっとだけ好きな社労士




分圧



2



0 件のコメント:
コメントを投稿